 |
Морской биобанк ...ресурсная коллекция, центр коллективного использования |
Шапочка список
ННЦМБ
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Liquid nitrogen vapor BIOSAFE 420
Fig_4a.jpg
Fig._17a.jpg
Fig._7a.jpg
Материалы и методика
В главе представлена информация о коллекции культур микроводорослей ИБМ ДВО РАН. Приводится список видов микроводорослей, поддерживающихся в коллекции в настоящее время, определены основные направления работы с коллекцией.
В России до сих пор нет единой коллекции чистых культур водорослей как фонда хранения генетического материала альгофлоры. В различных научных институтах поддерживаются коллекции культур пресноводных и морских микроводорослей, созданные с разными целями. К таковым относится и коллекция культур морских микроводорослей ИБМ ДВО РАН.
Основной путь пополнения нашей коллекции – выделение в культуру отдельных представителей фитопланктона из прибрежных вод Японского моря, а также из вод других дальневосточных морей России. В настоящее время коллекция включает 31 вид и 39 штаммов морских микроводорослей, относящихся к разным систематическим группам (табл. 7). В настоящей работе принято деление водорослей на отделы, предложенное Д.К. Зеровым (1972), с изменениями, которые внесли Вассер с коллегами (1989).
Наиболее широко в коллекции представлены диатомовые водоросли (14 видов) и зеленые водоросли (8 видов).
Культуры водорослей в условиях коллекционного хранения являются альгологически чистыми и поддерживаются в жидких питательных средах различного минерального состава (среды f, f/2 и Гольдберга). Основную часть коллекции содержат в шкафах для хранения культур, оборудованных стеклянными полками и дверцами (рисунок).

Рисунок 23. Коллекция морских микроводорослей, хранящаяся в специальном шкафу для культивирования.
Водоросли культивируют при периодическом освещении (12 ч свет/12 ч темнота) люминесцентными лампами с интенсивностью 3000–3500 лк при температуре 10–12ºС, 15ºС, 20–22ºС. Регулярно проверяется чистота культур.
Тематика научных исследований, проводимых в институте с использованием коллекционных культур водорослей, разнообразна. Культуры водорослей дают возможность детально изучать биологию, жизненный цикл, особенности морфологии того или иного вида. Систематика и точная идентификация многих видов Bacillariophyta, особенно представителей нано- и пикопланктона, с помощью световой микроскопии затруднены и требуют применения электронной микроскопии. В качестве примера можно привести тот факт, что до последнего времени в литературе существовала путаница в определении видов рода Attheya. Исследования, проведенные на альгологически чистой культуре, позволили обнаружить новый для морей России вид микроводорослей – Attheya longicornis Crawford et Gardner (Орлова и др., 2002). С помощью метода лабораторных культур выделены новые для дальневосточных морей России виды, такие как Chaetoceros socialis f. radians и Thalassiosira proschkinae var. spinulata.
Коллекция культур водорослей имеет эталонную ценность, так как включает аутентичные штаммы, которые выделены из проб, собранных в прибрежных районах зал. Петра Великого (Японское море). Выделение одного из типовых штаммов послужило основой для описания нового вида Attheya ussurensis Stonik, Orlova et Crawford с типовым штаммом AU-01 (Stonik et al., 2006).
Значительная морфологическая изменчивость клеток водорослей на протяжении жизненного цикла, в особенности представителей рода Chaetoceros (Прошкина-Лавренко, 1955; Орлова, Айздайчер, 2000), может служить причиной для выделения в самостоятельный вид отдельной его стадии. Изучение в культуре мелкоклеточной водоросли C. socialis f. radians позволило получить более полную информацию о морфологических особенностях вида на разных стадиях жизненного цикла, что дало возможность наиболее точно определить его таксономический статус (Шевченко и др., 2008).
Известно, что микроводоросли – основные продуценты органического вещества в морских экосистемах и главный источник пищи для водных животных-фильтраторов. Используя их в пищу, животные получают жизненно важные жирные кислоты, которые не могут синтезировать самостоятельно. Для оценки биологического значения водорослей необходимо знать их жирнокислотный состав. В связи с этим проанализирован состав жирных кислот микроводорослей, представленных в коллекции ИБМ ДВО РАН (Zhukova, Aizdaicher, 1995). Установлено, что качественный и количественный состав жирных кислот можно использовать для оценки физиологического состояния клеток. На примере диатомовых водорослей Pseudo-nitzschia pungens (Grun.) Hasle и Chaetoceros salsugineus Takano показано, что с увеличением возраста культуры в клетках нарушалось образование жирных кислот, обеспечивающих нормальную жизнедеятельность (Жукова и др., 1998; Zhukova, Aizdaicher, 2001).
Коллекция содержит виды микроводорослей, представляющие интерес для экологических и физиологических исследований. Некоторые виды широко используются в качестве тест-объектов при биотестировании химических веществ и образцов природных и загрязненных вод. Короткий жизненный цикл микроводорослей позволяет проследить действие загрязняющих веществ на нескольких поколениях. Так, изучение роста ряда видов микроводорослей в присутствии детергентов позволило выявить концентрации этих веществ, стимулирующих или ингибирующих развитие водорослей. Кроме того, установлены межвидовые различия в отклике микроводорослей на загрязнения среды детергентами, что позволило расположить виды по уменьшению чувствительности к загрязнению и установить для них пороговые концентрации детергентов (Айздайчер и др., 1999).
В России наиболее распространены биотесты с использованием в качестве тест-объектов зеленых микроводорослей родов Chlorella и Dunaliella. На базе коллекции ИБМ ДВО РАН проводится поиск новых объектов для тестирования морской воды с использованием такого показателя как подвижность клеток микроводорослей (Айздайчер, Маркина, 2006). Реунова с соавторами (2007) описали типы ультраструктурных повреждений в клетке зеленой водоросли Dunaliella salina и определили концентрации селена, приводящие к тотальной клеточной деструкции.
Прибрежные воды, из которых выделены водоросли, представленные в коллекции ИБМ ДВО РАН, испытывают значительное влияние опреснения. Соленость поверхностной воды в летнее время в зал. Петра Великого Японского моря в период тайфунов снижается до 4.25‰ (нормальная соленость составляет 32–34‰) и восстанавливается лишь через трое суток (Гайко, Жабин, 1996). Устойчивость разных видов микроводорослей к опреснению неодинакова. На культурах из коллекции ИБМ ДВО РАН изучено отношение к опреснению нескольких видов водорослей, принадлежащих к разным систематическим отделам. На основании этих опытов условно можно выделить три группы видов, по-разному реагирующих на опреснение: 1) виды, переносящие опреснение до 4‰ (Plagioselmis prolonga, Chlorella minutissima, Nannochloris maculata); 2) виды, переносящие опреснение до 16‰ (Pyramimonas cordata, Heterosigma akashiwo, Chaetoceros salsugineus); 3) виды, способные без нарушения роста выдерживать опреснение до 24‰ (Chaetoceros socialis f. radians, Corethron histrix).
В альгологически чистых культурах, как и в прибрежных сообществах, микроводоросли развиваются в тесном контакте с бактериями. В этом случае организмы влияют друг на друга, что приводит либо к стимуляции роста водорослей, либо к его ингибированию. Регуляторная функция экзометаболитов микроводорослей по отношению к бактериям изучена недостаточно. В лабораторных экспериментах культуры водорослей из коллекции ИБМ ДВО РАН используются для изучения взаимоотношений патогенных бактерий и микроводорослей (Терехова и др., 2006).
Микроводоросли из коллекции ИБМ ДВО РАН используются в учебно-педагогическом процессе Дальневосточного государственного университета.
Таким образом, основной принцип работы с коллекцией микроводорослей ИБМ ДВО РАН – это, прежде всего, увеличение таксономического разнообразия коллекции путем пополнения ее видами, являющимися объектами альгологических, биохимических и генетических исследований, перспективных с точки зрения биотехнологии и биотестирования.
Таблица 7
Список штаммов микроводорослей коллекции Института биологии моря им. А.В. Жирмунского ДВО РАН
Вид, шифр штамма |
Cреда для культивирования |
Температура культивиро-вания, ºC |
Оригинатор вида |
История происхождения |
|
Отдел Bacillariophyta |
||||
|
Attheya arenicola |
||||
|
AА-03 |
f |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Attheya longicornis |
||||
|
AL-02 |
f |
20 |
Айздайчер Н.А. |
Амурский залив, Японское море |
|
Attheya longicornis |
||||
|
AL-10 |
f |
20 |
Стоник И.В. |
Амурский залив, Японское море |
|
Attheya ussurensis |
||||
|
AU-01 |
f |
20 |
Айздайчер Н.А. |
Уссурийский залив, Японское море |
|
Сhaetoceros muelleri |
||||
|
СМ-88 |
f |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Сhaetoceros socialis f. radians |
||||
|
СSR-02 |
f |
20 |
Айздайчер Н.А. |
Амурский залив, Японское море |
|
Сhaetoceros sp. |
||||
|
C-91 |
f |
20 |
Неизвестен |
Рыбохозяйственный институт, Циндао, Китай |
|
Ditylum brightwellii |
||||
|
Dit-04 |
f |
10–12 |
Шевченко О.Г. |
Амурский залив, Японское море |
|
Phaeodactylum tricornutum |
||||
|
PT-85 |
f |
20 |
Ланская Л.А. |
Коллекция ИнБЮМ НАНУ |
|
Pseudo-nitzschia сalliantha |
||||
|
PPD-02 |
f |
20–22 |
Айздайчер Н.А. |
Уссурийский залив, Японское море |
|
Pseudo-nitzschia pungens |
||||
|
PP-07 |
f |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Pseudo-nitzschia pungens |
||||
|
PP-08 |
f |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Pseudo-nitzschia pungens |
||||
|
PP-081 |
f |
20 |
Айздайчер Н.А. |
Б. Золотой Рог, Японское море |
|
Pseudo-nitzschia pungens |
||||
|
PP-10 |
f |
10–12 |
Стоник И.В. |
Б. Золотой Рог, Японское море |
|
Pseudo-nitzschia multiseries |
||||
|
PM-02 |
f |
20–22 |
Айздайчер Н.А. |
Амурский залив, Японское море |
|
Pseudo-nitzschia multistriata |
||||
|
PMS-04 |
f |
20–22 |
Айздайчер Н.А. |
Амурский залив, Японское море |
|
Skeletonema sp. |
||||
|
Sk-0617 |
f |
10–12 |
Шевченко О.Г. |
Амурский залив, Японское море |
|
Thalassiosira proshkinae var. spinulata |
||||
|
TPS-02 |
f |
20 |
Айздайчер Н.А. |
Амурский залив, Японское море |
|
Отдел Dinophyta |
||||
|
Alexandrium tamarense |
||||
|
ATRU-16 |
f/2 |
15 |
Орлова Т.Ю. |
Амурский залив, Японское море |
|
Alexandrium tamarense |
||||
|
ATRU-22 |
f/2 |
15 |
Орлова Т.Ю. |
Авачинская губа, полуостров Камчатка |
|
Alexandrium tamarense |
||||
|
ATRU-2/1 |
f/2 |
15 |
Орлова Т.Ю. |
Берингово море |
|
Alexandrium tamarense |
||||
|
ATA-10 |
f/2 |
15 |
Орлова Т.Ю. |
Зал. Анива Охотское море |
|
Amphidinium carterae |
||||
|
AC-Москва |
f/2 |
15 |
Неизвестен |
Коллекция МГУ, Москва |
|
Amphidinium carterae |
||||
|
AC10/1 |
f/2 |
15 |
Селина М.С. |
Б. Соболь, Уссурийский залив, Японское море |
|
Gymnodinium kovalevskii |
||||
|
GK-85 |
Гольдберга |
20 |
Ланская Л.А. |
Коллекция ИнБЮМ НАНУ |
|
Oxyrrhis marina |
f/2 |
20 |
Айздайчер Н.А. |
Б. Золотой Рог, Японское море |
|
OM-00 |
||||
|
Отдел Сhrysophyta |
||||
|
Isochrysis galbana |
||||
|
TISO |
f |
20 |
K. Haines |
CCMP, США |
|
Отдел Chlorophyta |
||||
|
Dunaliella salina |
||||
|
DS-85 |
Гольдберга |
20 |
Ланская Л.А. |
Коллекция ИнБЮМ НАНУ |
|
D. tertiolecta |
||||
|
DT-85 |
Гольдберга |
20 |
Ланская Л.А. |
Коллекция ИнБЮМ НАНУ |
|
Platymonas viridis |
||||
|
PV-85 |
Гольдберга |
20 |
Ланская Л.А. |
Коллекция ИнБЮМ НАНУ |
|
P. suecica |
||||
|
PS-93 |
Гольдберга |
20 |
Неизвестен |
НЭКМ, пос. Большой Утриш, Украина |
|
Tetraselmis maculata |
||||
|
ТМ-93 |
Гольдберга |
20 |
Неизвестен |
НЭКМ, пос. Большой Утриш, Украина |
|
Platymonas sp. |
||||
|
P-86 |
Гольдберга |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Nannochloris maculata |
||||
|
NM-86 |
Гольдберга |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Chlorella minutissima |
||||
|
CМ-86 |
Гольдберга |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Отдел Cryptophyta |
||||
|
Chroomonas salina |
||||
|
CS-92 |
f |
20 |
Айздайчер Н.А. |
Амурский залив, Японское море |
|
Plagioselmis prolonga |
||||
|
PP-02 |
f |
20 |
Айздайчер Н.А. |
Б. Золотой Рог, Японское море |
|
Отдел Xanthophyta |
||||
|
Nannochloropsis sp. |
||||
|
N-86 |
Гольдберга |
20 |
Айздайчер Н.А. |
Зал. Восток, Японское море |
|
Отдел Rhodophyta |
||||
|
Porphyridium cruentum |
||||
|
PC-85 |
Гольдберга |
20 |
неизвестен |
Коллекция БиНИИ ЛГУ |
П р и м е ч а н и е. ИнБЮМ НАНУ − Институт биологии южных морей Национальной академии наук Украины. ССМP − Национальный центр культивирования морского фитопланктона (Center for culture of marine phytoplankton, Bigelow laboratory for ocean sciences, West Boothbay Harbor, Maine 04575 U.S.A.). НЭКМ − Научно-экспериментальный комплекс марикультуры, пос. Большой Утриш, Украина. БиНИИ ЛГУ − Ботанический институт Ленинградского государственного университета, г. Ленинград.
Полученные культуры микроводорослей поддерживают длительное время и, в случае необходимости, наращивают в нужных объемах. Для сохранения альгологически чистой культуры в течение длительного времени маточную культуру, находящуюся на стадии экспоненциального роста, регулярно, не реже одного раза в 5 сут, пересевают в свежеприготовленную питательную среду f.
Плотность маточной культуры на стадии экспоненциального роста должна составлять не менее 1×104 клеток/мл.
Для проведения работ по пересеву культур микроводорослей предварительно подготавливают рабочее место и посуду в соответствии с рекомендациями, данными в разделе 5. Процедура дезинфекции рук и рабочих поверхностей, которая должна предшествовать пересеву, описана в разделе 8.
Маточную культуру объемом 1 мл стерильными пастеровскими пипетками вносят в колбы Эрленмейера, содержащие 50–70 мл свежеприготовленной среды f.
Плотность культуры клеток после пересева должна составлять не менее 200 клеток/мл.
Колбы Эрленмейера, содержащие культуры микроводорослей, инкубируют в климатостате при тепературе 15–18°С, освещенности 3500 лк и режиме освещения 12 ч свет/12 ч темнота (рис. 20).

Рисунок 20. Климатостат, содержащий колбы и чашки Петри c культурами Pseudo-nitzschia.
Ежедневно проводятся мониторинг культур и их перемешивание: последовательность действий изложена в разделе Поддержание культур.
В процессе работы с накопительными культурами отдельных видов рода Pseudo-nitzschia были отмечены некоторые особенности их роста в условиях перемешивания и без перемешивания.
В накопительной культуре при перемешивании рост численности P. multiseries (клон PM-02) характеризуется S-образной кривой (рис. 21).
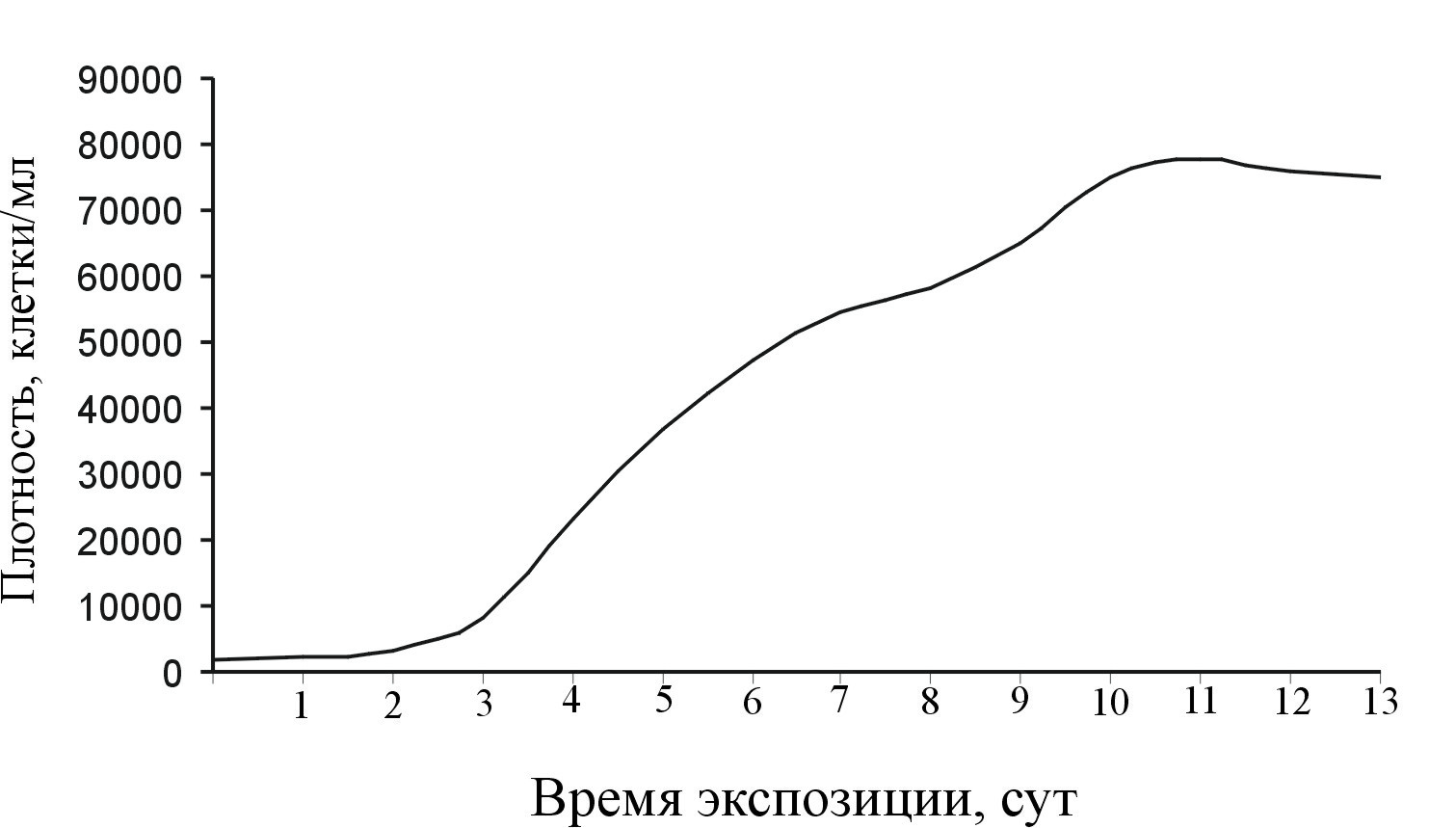
Рисунок 21. Рост плотности клеток Pseudo-nitzschia multiseries в культуре в условиях перемешивания.
Плотность исходной культуры должна составлять не менее 1500–2000 клеток/мл. Лаг-фаза короткая, не более 2–3 сут. Суспензия представлена короткими цепочками клеток. Хлоропласты окрашены в зеленовато-коричневый цвет. Через 4 сут происходит переход культуры на экспоненциальную фазу роста. В этот период наблюдается максимальная скорость деления (2–2.5 деления в сутки). В суспензии преобладают короткие колонии клеток. Продолжительность экспоненциальной фазы составляет 3–4 сут. Плотность клеток на стадии экспоненциального роста варьирует от 2×104 до 6×104 клеток/мл. Через 7 сут скорость роста замедляется до 0.3–0.5 деления в сутки, и культура переходит в стационарную стадию. Хлоропласты окрашиваются в темно-коричневый цвет. Колонии распадаются на отдельные клетки, которые равномерно оседают на дно колбы. Через 14–16 сут хлоропласты обесцвечиваются, и культура отмирает.
Рост численности P. multiseries (клон PM-02) в накопительной культуре без перемешивания существенно отличается (рис. 22).
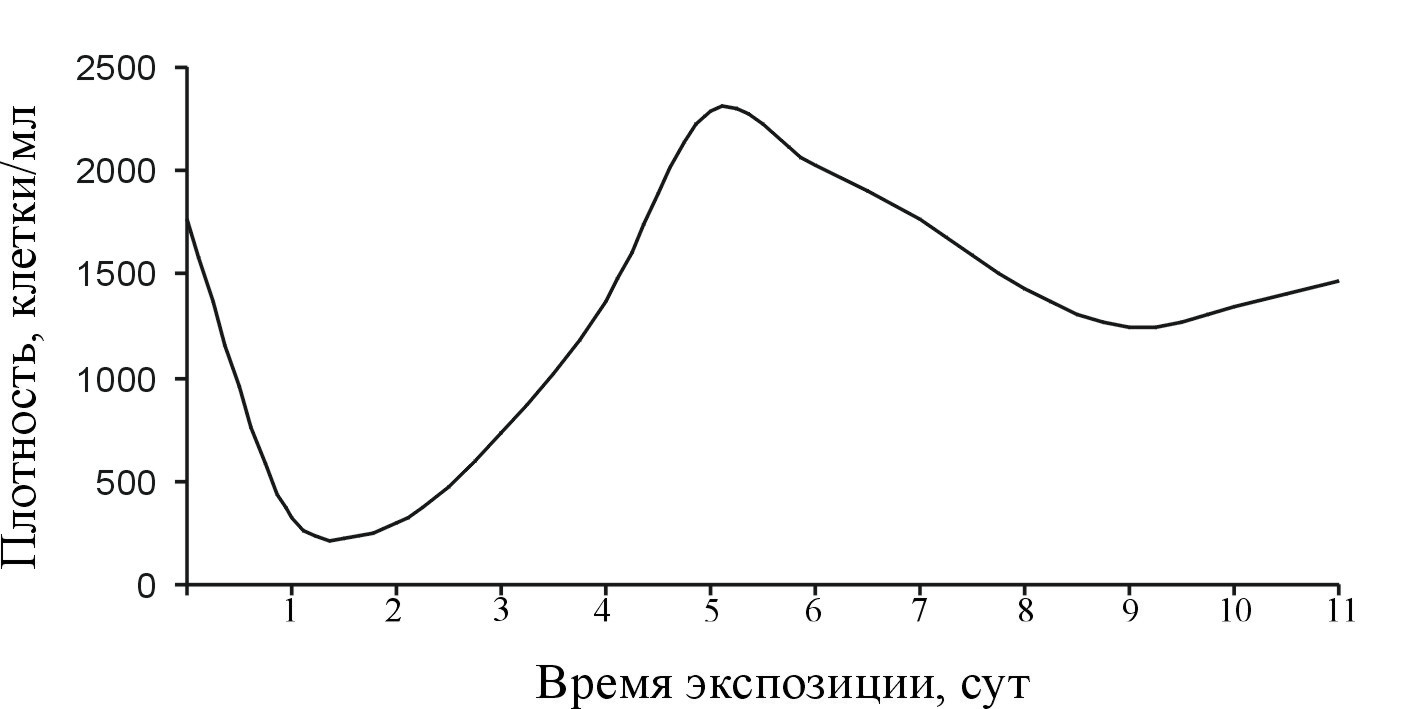
Рис. 22. Рост плотности клеток Pseudo-nitzschia multiseries в культуре без перемешивания.
Плотность исходной культуры составляет 1500–2000 клеток/мл. Лаг-фаза короткая, не более 2–3 сут. Плотность клеток в этот период уменьшается в два раза по сравнению с плотностью исходной культуры. Через 4 сут численность клеток в накопительной культуре достигает плотности исходной культуры. (1000–2000 клеток/мл).
Суспензия представлена в основном длинными колониями клеток. Хлоропласты окрашены в светло-зеленый цвет. Колонии клеток частично оседали на дно колбы, образуя четко сформированное кольцо, окрашенное в золотистый цвет. В таком состоянии они оставались в течение 45–50 сут, и только после этого происходило постепенное обесцвечивание хлоропластов. Колонии клеток были длинными.
Таким образом, перемешивание накопительной культуры Pseudo-nitzschia способствует более интенсивному делению клеток во время экспоненциального роста и быстрому их отмиранию после достижения максимума численности. Перемешивание сказывается и на длине колоний: доля коротких колоний преобладала в течение большей части эксперимента. В том случае, когда суспензию не перемешивали (рис. 22), нарастание численности клеток было не таким интенсивным, развитие культуры сопровождалось несколькими пиками численности клеток. Доля длинных колоний в отсутствие перемешивания преобладала на протяжении всего эксперимента.
В том случае, если в отобранной пробе фитопланктона количество колоний нужного вида незначительно (1 колония на 7–10 полей зрения), прибегают к получению смешанной накопительной культуры микроводорослей. Для этого в 100 мл питательной среды f добавляют 20–30 мл из отобранной пробы фитопланктона, предварительно тщательно перемешав ее, разливают полученную суспензию в 3–4 чашки Петри диаметром 110 мм и экспонируют их на свету при температуре 20ºС в течение 2–3 сут. Затем все чашки просматривают. В случае обнаружения необходимого количества колоний нужного вида (1–2 в поле зрения) приступают к процедуре его выделения в чистую культуру.
Порядок и последовательность действий описаны в разделе "Получение альгологически чистой культуры". После получения альгологически чистой культуры водоросли переносят из чашек Петри в колбы Эрленмейера для получения накопительной монокультуры.
Небольшую часть накопительной культуры или пробы планктона, содержащей достаточное количество клеток и/или колоний (цепочек) нужного вида, помещают в чашку Петри диаметром 55 или 90 мм или в счетную камеру «Седвик-Рафтер» (Sedgewick Rafter Counting Сells) объемом 1 мл и изолируют одну клетку или одну колонию стерильной капиллярной пипеткой. В течение 10–15 мин изолированную клетку или колонию отмывают от сопутствующего фитопланктона путем трехкратного перенесения в капли стерильной морской воды, нанесенные на стерильное предметное стекло. Затем изолированную и отмытую клетку или колонию стерильной пипеткой переносят в стерильные чашки Петри с питательной средой f. Одна клетка и/или колония помещается в одну чашку Петри. Для успешного получения монокультуры необходимо изолировать не менее 10 клеток и/или колоний.
Чашки Петри с изолированными клетками и/или колониями помещают в климатостат и экспонируют при температуре 18±2°С и освещенности 3500 лк люминесцентными лампами со свето-темновым периодом 12 ч свет/12 ч темнота в течение 3–4 сут (для отдельных видов, например, P. calliantha, чашки с изолированными клетками и/или колониями экспонируют в течение 7–10 сут). Затем содержимое всех чашек просматривают под микроскопом и, в случае увеличения количества клеток и/или колоний, повторяют процесс их изолирования до получения альгологически чистой культуры (монокультуры), которая характеризуется отсутствием в чашках других видов микроводорослей и наличием 2–3 одиночных клеток и/или колоний нужного вида в поле зрения. Затем суспензию клеток из чашки, в которой была монокультура, переносят в коническую колбу Эрленмейера объемом 100 мл, содержащую 50–70 мл питательной среды f; по мере возрастания концентрации клеток в суспензии объем среды постепенно увеличивают. Плотность засева должна составлять не менее 1000 клеток/мл.
Для проведения работ по изоляции водорослей необходимо отбирать не менее 1 л морской воды. Объем отбираемой воды должен быть в 2-3 раза больше объема, требуемого для работы. Методы отбора,траснспортировка, хранение и подготовка к выделению водорослей в культуру должны обеспечить сохранность проб в интервале времени между отбором проб и работой с ними, который не должен превышать 24 ч. Отбор проб из поверхностных и глубоких слоев воды осуществляется в соотвествии с ГОСТ 17.1.5.05-85 "Охрана природы. Общие требования к отбору проб поверхностных и морских вод,льда и атмосферных осадков". Для отбора проб используют устройства, соотвествующие требованиям ГОСТ 17.1.5 04-81 "Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия."
При отборе проб воды для последующего выделения водорослей в культуру не рекомендуется использовать металлические и полиэтиленовые емкости, а также емкости, бьывшие в употреблении.
Отообранные пробы наливают, предварительно дважды ополаскивая отбираемой водой, в емкости, заполняют их до краев и плотно закрывают пробкой. Пробы снабжают этикетками с указанием времени и места отбора пробы, упаковывают в коробки. Для лучшей сохранности в жаркую погоду пробы транспортируют в контейнерах-холодильниках при температуре от 4 до 10 0C . Не рекомендуется на длительное время оставлять пробы без освещения.
При отборе проб составляют протокол по утвержденной форме (Приложение 2), в котором указывают цель пробоотбора, число, время, место отбора пробы, температуру воды и результаты других измерений, номер пробы.
Работу по изолированию водорослей приводят после адаптации температуры пробы к температуре в лаборатории, но не позднее чем через 6 ч после отбора. Хранить пробы можно в течении 24 ч после отбора.
Для получения клоновой культуры используют накопительную культуру, полученную при проращивании одной цисты[1].
На стерильное предметное стекло наносят каплю накопительной культуры, содержащей подвижные клетки. На второе стерильное предметное стекло наносят не менее трех капель стерильной среды f/2. Из капли с накопительной культурой микрокапилляром отлавливают одиночную подвижную клетку и переносят ее на предметное стекло в каплю среды. Затем клетку переносят в следующую каплю; этот процесс повторяют не менее трех раз, каждый раз меняя стерильный микрокапилляр. Отмытую изолированную клетку при помощи стерильного микрокапилляра помещают в отдельную пробирку, содержащую 5 мл среды f/2.
Для успешного получения клоновой культуры необходимо изолировать не менее 25 клеток. По окончании этой процедуры пробирки закрывают стерильными колпачками и помещают в климатостат с температурой 15°С, освещенностью 3500 лк и свето-темновым периодом 12 ч свет/12 ч темнота. Через 3 сут и далее ежедневно проводят мониторинг выделенных клеток под микроскопом: просматривают содержимое каждой пробирки и информацию вносят в журнал с указанием даты наблюдения.
После увеличения количества подвижных клеток (до плотности не менее 1000 клеток/мл) 1 мл культуры переносят в колбы Эрленмейера или пластиковые флаконы для культивирования с объемом питательной среды 50 мл (рис. 18).

Рисунок 18. После увеличения количества подвижных клеток динофлагеллят их переносят из пробирок в пластиковые флаконы и/или колбы Эрленмейера.
Пластиковые флаконы и/или колбы Эрленмейера помещают в климатостат (рис. 19) с температурой 15°С, освещенностью 3500 лк и свето-темновым периодом 12 ч свет/12 ч темнота.

Рисунок 19. Климатостат, содержащий клоновые культуры динофлагеллят рода Alexandrium.
Численность культуры на стадии экспоненциального роста должна быть не менее 1×104 клеток/мл. Для поддержания экспоненциального роста клоновых культур динофлагеллят рода Alexandrium пересев на свежеприготовленную среду f/2 осуществляется регулярно один раз в 7 сут.
Порядок действий и последовательность пересевов описаны в разделе "Поддержание культур".
[1]Покоящаяся циста динофлагеллят образуется в результате полового размножения и является диплоидной (то есть несет двойной набор хромосом, 2N). Для получения клоновой культуры (то есть культуры клеток, генетически идентичных исходному материалу) необходимо получить культуру из одной гаплоидной (вегетативной) клетки.
В настоящей главе даны методические рекомендации для лабораторного культивирования морских диатомовых водорослей рода Pseudo-nitzschia, известных как продуценты нейротоксичной домоевой кислоты (Subba Rao et al., 1988; Bates et al., 1989; Martin et al., 1990). В периоды активного размножения этих водорослей в тканях моллюсков и других морских животных, питающихся ими, аккумулируются значительные количества этого токсина.
Отравление, вызванное токсичными диатомеями, получило название Amnesic Shellfish Poisoning (ASP) – отравление домоевой кислотой, или «амнезийное отравление» (Bates, 2000). Продукция домоевой кислоты диатомовыми водорослями, как и продукция многих других вторичных метаболитов простейших, грибов и бактерий, определяется влиянием многочисленных факторов. К ним относятся химические (дефицит некоторых питательных элементов, в особенности кремния и фосфора), физические (температура, освещенность) и биологические (влияние бактерий) факторы (Pan et al., 1998).
Экспериментально установлено, что существует положительная корреляция между продукцией домоевой кислоты и численностью бактерий в неаксенических культурах Pseudo-nitzschia. Однако нет доказательств, что бактерии способны синтезировать домоевую кислоту в отсутствие диатомей. Некоторые органические соединения (глюконолактон, глюконовая кислота), известные как продукты жизнедеятельности ряда бактерий, стимулируют продукцию домоевой кислоты (Pan et al., 1998). Однако установлено, что эти соединения продуцируют только немногие виды бактерий (например, Alteromonas sp.). Экспериментально показано, что добавление Alteromonas macleodii в аксеничные культуры P. multiseries усиливало продукцию домоевой кислоты. Таким образом, некоторые виды бактерий в условиях искусственного культивирования Pseudo-nitzschia играют существенную, но не основную роль в процессе синтеза домоевой кислоты. Однако роль бактерий-эпифитов диатомей в продуцировании домоевой кислоты in vivo остается недостаточно изученной (Bates et al., 2004).
Способность диатомей к синтезу домоевой кислоты обратно пропорциональна их первичной метаболической активности. Продукция токсина усиливается, когда снижается интенсивность процессов первичного метаболизма, например, в условиях дефицита кремния, фосфора, а также при недостатке некоторых витаминов и микроэлементов. В результате такого ограничения появляются богатые энергией соединения и кофакторы, необходимые для биосинтеза домоевой кислоты, а также индуцируется экспрессия генов, кодирующих ферменты, регулирующих синтез домоевой кислоты. Экспериментальные данные подтверждают точку зрения, согласно которой продукция домоевой кислоты является реакцией на физиологический стресс, испытываемый диатомеями (Pan et al., 1998).
В настоящее время 9 видов рода Pseudo-nitzschia известны как потенциальные продуценты домоевой кислоты. Установлено также, что продуцентами домоевой кислоты, наряду с представителями рода Pseudo-nitzschia, являются диатомеи Nitzschia navis-varingica Lundholm et Moestrup и Amphora coffeaeformis (Agardh) Kutzing (Maranda et al., 1990; Bates, 2000; Lundholm, Moestrup, 2000).
Для большинства видов рода Pseudo-nitzschia установлено существование как токсичных, так и нетоксичных клонов (клеточных линий). Уровень продукции токсина часто существенно различается у разных клонов. Различия в способности разных клонов продуцировать домоевую кислоту могут быть вызваны генетической изменчивостью и влиянием природных факторов. Среди видов-возбудителей ASP наиболее часто токсичные «цветения» вызывают P. multiseries, виды группы P. pseudodelicatissima/cuspidata и P. australis.
Методика культивирования видов рода Pseudo-nitzschia была успешно применена в ИБМ ДВО РАН для выделения и получения альгологически чистых культур потенциально токсичных видов P. pungens, P. multiseries, P. multistriata и P. calliantha (Приложения 4 и 5). Для культивирования этих видов использовали только питательную среду f (Guillard, Ryther, 1962). Методика приготовления питательной среды f изложена в разделе 6. Диатомовые водоросли рода Pseudo-nitzschia классифицированы с использованием системы, предложенной Г. Хасле и Э. Сивертсеном (Hasle, Syvertsen, 1997).
После увеличения количества подвижных клеток (3–5 вегетативных клеток в поле зрения) весь объем питательной среды f/2, содержащий проросшие клетки, из лунки переносят в пробирки с объемом питательной среды 5 мл (рис. 17).

Рисунок 17. Проросшие клетки переносят из лунок планшета в пробирки с питательной средой.
Плотность засева составляет не менее 10 клеток/мл. Пробирки помещают в климатостат с температурой 15°С, освещенностью 3500 лк и свето-темновым периодом 12 ч свет/12 ч темнота.











