 |
Морской биобанк ...ресурсная коллекция, центр коллективного использования |
Шапочка список
ННЦМБ
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Liquid nitrogen vapor BIOSAFE 420
Fig_4a.jpg
Fig._17a.jpg
Fig._7a.jpg
Материалы и методика
Айздайчер Н.А., Малынова С.И., Христофорова Н.К. Влияние детергентов на рост микроводорослей // Биол. моря. 1999. Т. 25, № 3. С. 234–238.
Айздайчер Н.А., Маркина Ж.В. Токсическое действие детергентов на водоросли Plagioselmis prolonga (Cryptophyta) // Биол. моря. 2006. Т. 32, № 1. С. 50–54.
Вассер С.П., Кондратьева Н.В., Масюк Н.П., Паламарь-Мордвинцева Г.М., Ветрова З.И., Кордюм Е.Л., Мошкова Н.А., Приходькова Л.П., Коваленко О.В., Ступина В.В., Царенко П.М., Юнгер В.П., Радченко М.И., Виноградова О.Н., Бухтиярова Л.Н., Разумна Л.Ф. Водоросли. Справочник. Киев: Наукова Думка, 1989. 608 с.
Гайко Л.А., Жабин И.А. Изменчивость температуры и солености в районе плантаций мидий в заливе Восток Японского моря // Биол. моря. 1996. Т. 22, № 2. С. 126–130.
Жукова Н.В., Орлова Т.Ю., Айздайчер Н.А. Жирнокислотный состав как показатель физиологического состояния диатомовой водоросли Pseudo-nitzschia pungens в природной среде и в культуре // Биол. моря. 1998. Т. 24, № 1. С. 44–48.
Зеров Д.К. Очерк филогении бессосудистых растений. Киев: Наукова Думка, 1972. 315 с.
Кабанова Ю.Г. О культивировании в лабораторных условиях морских планктонных диатомовых и перидиниевых водорослей // Труды ИО АН СССР. 1961. Т. 47. С. 203–216.
Коновалова Г.В., Орлова Т.Ю., Паутова Л.А. Атлас фитопланктона Японского моря. Л.: Наука, 1989. 160 с.
Коновалова Г.В. «Красные приливы» и «цветение» воды в дальневосточных морях России и прилегающих акваториях Тихого океана // Альгология. 1992. Т. 2, № 4. С. 87–93.
Коновалова Г.В. «Красные приливы» в дальневосточных морях России и прилегающих акваториях Тихого океана (Обзор) // Биол. моря. 1999. Т. 25, № 4. С. 263–273.
Ланская Л.А. Культивирование водорослей // Экологическая физиология морских планктонных водорослей. Киев: Наукова думка, 1971. С. 5–21.
Орлова Т.Ю., Айздайчер Н.А. Особенности развития в культуре диатомовой водоросли Chaetoceros salgugineus из Японского моря // Биол. моря. 2000. Т. 26, № 1. С. 11–15.
Орлова Т.Ю., Стоник И.В., Айздайчер Н.А. Морфология и биология диатомовой водоросли Attheya longicornis из Японского моря // Биол. моря. 2002. Т. 28, № 3. С. 203–207.
Прошкина-Лавренко А.И. Диатомовые водоросли планктона Черного моря. М., Л.: Издательство Академии наук СССР, 1955. 222 с.
Реунова Ю.А., Айздайчер Н.А., Христофорова Н.К., Реунов А.А. Рост и ультраструктура морской одноклеточной водоросли Dunaliella salina (Chlorophyta) после хронической токсикации селеном // Биол. моря. 2007. Т. 33, № 3. С. 202–208.
Селина М.С., Коновалова Г.В., Морозова Т.В., Орлова Т.Ю. Род Alexandrium Halim, 1960 (Dinophyta) у тихоокеанского побережья России: видовой состав, распределение, динамика // Биол. моря. 2006. Т. 32, № 6. С. 384–394.
Терехова В.П., Айздайчер Н.А., Карпенко А.А., Бузолева Л.С., Сомов Г.П. Изучение характера взаимоотношений морских диатомовых водорослей с бактериями вида Listeria monocytogenes // Микробиология. 2006. Т. 75, № 1. С 90–93.
Шевченко О.Г., Орлова Т.Ю., Айздайчер Н.А. Развитие в культуре диатомовой водоросли Chaetoceros socialis f. radians (Schütt) Proschkina-Lavrenko 1963 // Биол. моря. 2008. Т. 34, № 4. С. 268–273.
Algal Culturing Techniques / Ed. R.A. Andersen. Elsevier Academic Press, 2005. 579 p.
Allen E.J., Nelson E.W. On the artificial culture of marine plankton organisms // J. Mar. Biol. Assoc. U.K. 1910. Vol. 8. P. 421–474.
Balech E. The genus Alexandrium or Gonyaulax of the tamarensis group. // Toxic dinoflagellates / Eds. D.M. Anderson, A.W. White, D.G. Baden. New York: Elsevier, 1995. P. 33–38.
Bates S.S., Bird C.J., de Freitas A.S.W., Foxall R., Gilgan M., Hanic L.A., Jonhson G.R., McCulloch A.W., Odense P., Pocklington R., Quilliam M.A., Sim P.G., Smith J.C., Subba Rao D.V., Todd E.C.D., Walter J.A., Wright J.L.C. Pennate diatom Nitzschia pungens as primary source of domoic acid, a toxin in schellfish from eastern Prince Edward Island, Canada // Can. J. Fish. Aquat. Sci. 1989. Vol. 46, no. 7. P. 1203–1215.
Bates S.S. Domoic-acid-producing diatoms: another genus added! // J. Phycol. 2000. Vol. 36, no. 6. P. 978–983.
Bates S.S., Gaudet J., Kaczmarska I., Ehrman J.M. Interaction between bacteria and the domoic-acid-producing diatom Pseudo-nitzschia multiseries (Hasle) Hasle: can bacteria produce domoic acid autonomously? // Harmful Algae. 2004. Vol. 3. P. 11–20.
Bold H.C. The cultivation of algae // Bot. Rev. 1942.Vol. 8. P. 69–138.
Cho E.S., Hur H.G., Byun H.S., Lee S.G., Rhodes L.L, Jeong C.S., Park J.G. Monthly monitoring of domoic acid producer Pseudo-nitzschia multiseries (Hasle) Hasle using species-specific DNA probes and WGA lectins and abundances of Pseudo-nitzschia species (Bacillariophyceae) from Chinhae Bay, Korea // Botanica Marina. 2002. Vol. 45, no. 4. P. 364–372.
Сhretiennot-Dinet M.J., Sournia A., Ricard M., Billard C. A classification of the marine phytoplankton of the world from class to genus // Phycologya. 1993. Vol. 32, no. 3. P. 159–179.
CRC Handbook of microalgal mass cultures / Ed. A. Richmond. Boca Raton, Florida: CRC. Press, 1986. 528 p.
Dale B., Yentsch C.M., Hurst J.W. Toxicity in resting cysts of the red tide dinoflagellate Gonyaulax excavata from deeper water coastal sediments // Science. 1978. Vol. 201, no. 4362. P. 1223–1225.
Fogg G.E. Algal cultures and phytoplankton ecology. Madison: University of Wisconsin Press, 1965. 126 p.
Guillard R.R.L., Ryther J.H. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve // Can. J. Microbiol. 1962. Vol. 8, no. 2. P. 229–239.
Guillard R.R.L. Culture of phytoplankton for feeding marine invertebrates // Culture of marine invertebrate animals / Eds. W.L. Smith, M.H. Chanley. New York: Plenum Press, 1975. P. 26–60.
Hallegraeff G.M. Harmful algal blooms: а global overview // Manual of harmful marine microalgae / Eds. G.M. Hallegraeff, D.M. Anderson, A.D. Cembella. Paris: UNESCO, 1995. P. 1–22.
Handbook of physiological methods. Culture methods and growth measurements / Ed. J.R. Stein. Cambridge: Cambridge University Press, 1973. 448 p.
Harrison P.J., Berges A.H. Algal culturing techniques / Ed. R.A. Andersen. Elsevier Academic Press, 2005. P. 21–33.
Hasle G.R., Syvertsen E.E. Marine diatoms // Identifying marine phytoplankton / Ed. C. Tomas. San Diego: Academic Press, 1997. 385 p.
Hasle G.R. Are most of the domoic acid-producing species of the diatom genus Pseudo-nitzschia cosmopolites? // Harmful Algae. 2002. Vol. 1. P. 137–146.
Kodama M., Ogata T., Sakamoto S., Sato S., Honda T., Miwatani T. Production of paralytic shellfish toxins by a bacterium Moraxella sp. isolated from Protogonyaulax tamarensis // Toxicon. 1990. Vol. 28, no. 6. P. 707–714.
Kotaki Y., Koike K., Sato S., Ogata T., Fukuyo Y., Kodama M. Confirmation of domoic acid production of Pseudo-nitzschia multiseries isolated from Ofunato Bay, Japan // Toxicon. 1999. Vol. 37. P. 677–682.
Küster E. Eine kultivierbare Peridinee // Arch. Protistenk. 1908. Bd. 2. S. 351–362.
Kuznetzov V.V., Stroganov B.P. The patriarch of Russian plant physiology. (On the 160th birthday of academician A.S. Faminzin) // Russ. J. Plant Physiology. 1995. Vol. 42. P. 297–302.
Lundholm N., Skov J., Pocklington R., Moestrup Ø. Studies on the marine planktonic diatom Pseudo-nitzschia. 2. Autecology of P. pseudodelicatissima based on isolates from Danish coastal waters // Phycologia. 1997. Vol. 36, no. 5. P. 381–388.
Lundholm N., Moestrup Ø. Morphology of marine diatom Nitzschia navis-virginica, sp. nov. (Bacillariophyceae), another producer of the neurotoxin domoic acid // J. Phycol. 2000. Vol. 36, no. 6. P. 1162–1174.
Maranda L., Wang R., Masuda K., Shimizu Y. Investigation of the source of domoic acid in mussels // Toxic marine phytoplankton / Eds. E. Graneli, B. Sundstrom, L. Edler, D.M. Anderson. New York: Elsevier, 1990. P. 300–304.
Martin J., Haya K., Burridge L., Wildish D. Nitzschia pseudodelicatissima – a source of domoic acid in the Bay of Fundy, eastern Canada // Mar. Ecol. Prog. Ser. 1990. Vol. 67. P. 177–182.
McLachlan J. Growth media-marine // Handbook of phycological methods: culture methods and growth measurements / Ed. J. Stein. Cambridge: Cambridge University Press, 1973. P. 25–51.
Moore G.T. Methods for growing pure cultures of algae // J. Appl. Microsc. 1903. Vol. 6. P. 2309–2314.
Ogata T., Kodama M. Ichthyotoxicity found in cultured media of Protogonyaulax spp. // Mar. Biol. 1986. Vol. 92. P. 31–34.
Orlova T.Yu., Selina M.S., Lilly E.L., Kulis D.M., Anderson D.M. Morphogenetic and toxin composition variability of Alexandrium tamarense (Dinophyceae) from the east coast of Russia // Phycologia. 2007. Vol. 46, no. 5. P. 534–548.
Orlova T.Yu., Stonik I.V., Aizdaicher N.A., Bates S.S., Leger C., Fehling J. Toxicity, morphology and distribution of Pseudo-nitzschia calliantha, P. multistriata and P. multiseries (Bacillariophyta) from the northwestern Sea of Japan // Botanica Marina. 2008. Vol. 51, no. 4. P. 297–306.
Orsini L., Sarno D., Procaccini G., Poletti R., Dahmann J., Montresor M. Toxic Pseudo-nitzschia multistriata (Bacillariophyceae) from the Gulf of Naples: morphology, toxin analysis and phylogenetic relationships with other Pseudo-nitzschia species // Eur. J. Phycol. 2002. Vol. 37. P. 247–257.
Oshima Y., Sugino K., Yasumoto T. Latest advances in HPLC analysis of paralytic shellfish toxins // Seventh International IUPAC Symposium on Mycotoxins and Phycotoxins / Eds. S. Natori, K. Hashimoto, Y. Ueno. Amsterdam: Elsevier, 1989. P. 319–326.
Pan Y., Bates S.S., Cembella A.D. Environmental stress and domoic acid production by Pseudo-nitzschia: a physiological perspective // Natural Toxins. 1998. Vol. 6. P. 127–135.
Pringsheim E.G. Kulturversuche mit chlorophyllführenden microorganismen. Mitt. 1. Die kultur von algen in agar // Beitr. Biol. Pfl. 1912. Bd. 11. S. 305–334.
Pringsheim E.G. Algenkultur // Handbuch der biologischen arbeitsmethoden. Abt. XI (2/1) / Ed. E. Abderhalden. Berlin: Urban und Schwarzenberg, 1924. S. 377–406.
Pringsheim E.G. The biphasic or soil-water culture method for growing algae and flagellata // J. Ecol. 1946. Vol. 33. P. 193–204.
Qi Y., Wang J., Zheng L. The taxonomy and bloom ecology of Pseudo-nitzschia on the coasts of China // Proceedings of IOC-WESTPAC the Third International Science Symposium. Bali, Indonesia, 1994. P. 88–95.
Rhodes L.L., White D., Syhre M., Atkinson M. Pseudo-nitzschia species isolated from New Zealand coastal waters: domoic acid production in vitro and links with shellfish toxicity // Harmful and toxic algal blooms / Eds. T. Yasumoto, Y. Oshima, Y. Fukuyo. Intergovernmental Oceanographic Comission of UNESCO, 1996. P. 155–158.
Rhodes L.L., Adamson J., Scholin C. Pseudo-nitzschia multistriata (Bacillariophyceae) in New Zealand // New Zealand J. Mar. Freshwater Res. 2000. Vol. 34. P. 463–467.
Richter O. Reinkultur von Diatomeen // Ber. Deutsch. Bot. Ges. 1903. Bd. 21. S. 493–506.
Sarno D., Dahlmann J. Production of domoic acid in another species of Pseudo-nitzschia: P. multistriata in the Gulf of Naples (Mediterranean Sea) // Harmful Algae News (IOC Newsletter, UNESCO). 2000. Vol. 2. P. 5.
Scholin C.A., Anderson D.M. Identification of group- and strain-specific genetic markers for globally distributed Alexandrium (Dinophyceae). I. RFLP analysis of SSU rRNA genes // J. Phycol. 1994. Vol. 30. P. 744–754.
Shumway S.E. A review of the effects of algal blooms on shellfish and aquaculture // J. World Aquacult. Soc. 1990. Vol. 21. P. 65–104.
Simonsen S., Moller B. L., Larsen J., Ravn H. Haemolytic activity of Alexandrium tamarense cell // Harmful algal blooms / Eds. P. Lassus, G. Arzul, E. Erard-Le-Denn, P. Gentien. Paris: Lavoisier, 1995. P. 513–517.
Sournia A. Atlas du phytoplancton marine. Vol. 1. Introduction, Cyanophycees, Dictyochophycees et Raphidophycees. Paris: Centre National de la Recherche Scientifique, 1986. 219 p.
Stonik I.V., Orlova T.Yu., Crawford R.M. Attheya ussurensis sp. nov. (Bacillariophyta) – a new marine diatom from the coastal waters of the Sea of Japan and a reappraisal of the genus // Phycologia. 2006. Vol. 45, no. 2. P. 141–147.
Subba Rao D.V., Quilliam M.A., Pocklington R. Domoic acid – a neurotoxic amino acid produced by the marine diatom Nitzschia pungens in culture // Can. J. Fish. Aquat. Sci. 1988. Vol. 45, no. 12. P. 2076–2079.
Takano H. Marine diatom Nitzschia multistriata sp. nov. common at inlets of southern Japan // Diatom. 1993. Vol. 8. P. 39–41.
Trainer V.L., Wekell J.C., Horner R.A., Hatfield C.L., Stein J.E. Domoic acid production in Pseudo-nitzschia pungens // Harmful Algae. Proceedings of the 8th International Conference on Harmful Algae, 25–29 June 1997, Vigo, Spain / Eds. B. Requera, J. Blanco, M. Fernandez, T. Wyatt. Santiago de Compostela, Spain: Xunta de Galicia and IOC of UNESCO Publishers, 1998. P. 337–340.
Uspenski E.E., Uspenskaja W.J. Reinkultur und ungeschlechtliche Fortpflanzung des Volvox minor and Volvox globator in einer synthetischen Nährlösung // Zeitschr. Bot. 1925. Bd 17. S. 273–308.
Villac M.C., Roelke D.L., Chavez F.P., Cifuentes L.A., Fryxell G.A. Pseudonitzschia pungens, P. australis Frenguelli and related species from the west coast of the U.S.A.: occurrence and domoic acid production // J. Shellfish Res. 1993. Vol. 12. P. 457–465.
Villac M.C., Matos M.G., Santos V.S., Rodriges A.W., Viana S.C. Composition and distribution of Pseudo-nitzschia from Guanabara Bay, Brazil: the role of salinity, based on field and culture observations // Harmful algae 2002 / Eds. K.A. Steidinger, J.H. Landsberg, C.R. Tomas, G.A. Vargo. Paris: Florida Fish and Wildlife Conservation Commission, Florida Institute of Oceanography, and Intergovernmental Oceanographic Commission of UNESCO, 2004. P. 56–58.
Yoshida M., Fukuyo Y. Taxonomy of armored dinoflagellate Alexandrium Halim based on morphology // Bull. Plankton Soc. Japan. 2000. Vol. 47. P. 34–43.
Zhukova N.V., Aizdaicher N.A. Fatty acid composition of some marine microalgae species // Phytochemistry. 1995. Vol. 39, no. 2. P. 351–356.
Zhukova N.V., Aizdaicher N.A. Lipid and fatty acid composition during vegetative and resting stages of the marine diatom Chaetoceros salsugineus // Botanica Marina. 2001. Vol. 44. P. 287–293.
|
Таксон |
|
|
Шифр клона |
ATRU-16 |
|
Иллюстрации |
ATRU-16_1–7 |
|
Класс |
Dinophyceae |
|
Порядок |
Peridiniales |
|
Семейство |
Gonyaulacaceae |
|
Род |
Alexandrium |
|
Морфологическое описание |
Клетки одиночные или в коротких цепочках, от круглых и округленно-пятиугольных до широкоовальных. Длина клетки равна ширине или превосходит ее (ATRU-16_1, 2). Эпитека тупоконическая, полусферическая или ширококоническая. Поясок экваториальный, глубокий, нисходящий, смещенный на ширину пояска (ATRU-16_1). Гипотека чашевидная или округло-коническая, обычно асимметричная, с ровными или выпукло-вогнутыми боками, в области антапекса ровная, чуть выпуклая или вогнутая (ATRU-16_2). Борозда хорошо выраженная, довольно глубокая, широкая (1–2 ширины пояска), с узкими мембрановидными выростами по краям, расширяющаяся книзу. Тека тонкая, кожистая, пронизана неравномерно расположенными порами, которые открываются наружу посередине небольших бугорков. Швы заметные, выступающие, ширина их зависит от возраста клетки. Табулярная формула теки: Po, 4', 6", 6C, 9-10S, 5'", 2"". Поровая пластинка (Ро) крупная, с большой основной порой в виде запятой (ATRU-16_4). Пластинки Ро, первая апикальная (1') и передняя бороздковая (Sa) сочленяются непосредственно, пластинка 1' правильно- или неправильно-ромбовидная (ATRU-16_3). Брюшная пора мелкая, круглая, находится посередине верхней правой стороны 1' пластинки, иногда немного выше или ниже середины (ATRU-16_5). Задняя бороздковая пластинка (Sp) бывает как с порой, так и без нее, длина её обычно превосходит ширину (ATRU-16_1, 6). Хлоропласты округлые или овальные, многочисленные, желтовато-коричневые, поперечно-вытянутое ядро расположено в области пояска. Вид образует покоящиеся споры или цисты (ATRU-16_7). |
Размеры клетки |
Длина 23–43 мкм, ширина 22.5–45 мкм |
|
Экология и распространение |
Неритический вид, широко распространен в прибрежных водах морей и океанов. Встречен во всех дальневосточных морях России и в прилегающих водах Тихого океана. Нередко вызывает токсичные красные приливы у восточных берегов Камчатки (Коновалова, 1992, 1999). Максимальная концентрация (7 млн. клеток/л) отмечена у тихоокеанских берегов Камчатки в июле–начале августа при температуре 14-15оС. |
|
Токсичность |
Метод высокоэффективной жидкостной хроматографии (HPLC) показал, что клон токсичен, содержит сакситоксин и его производные, характеризуется высоким содержанием токсинов С1, С2, неосакситоксина и гонитоксина 5 (Orlova et al., 2007) |
|
Изображение |
ATRU-16_1–7 |
|
Масштабная линейка |
ATRU-16_2, 3, 6, 7 - 10 мкм; ATRU-16_4, 5 - 5 мкм |
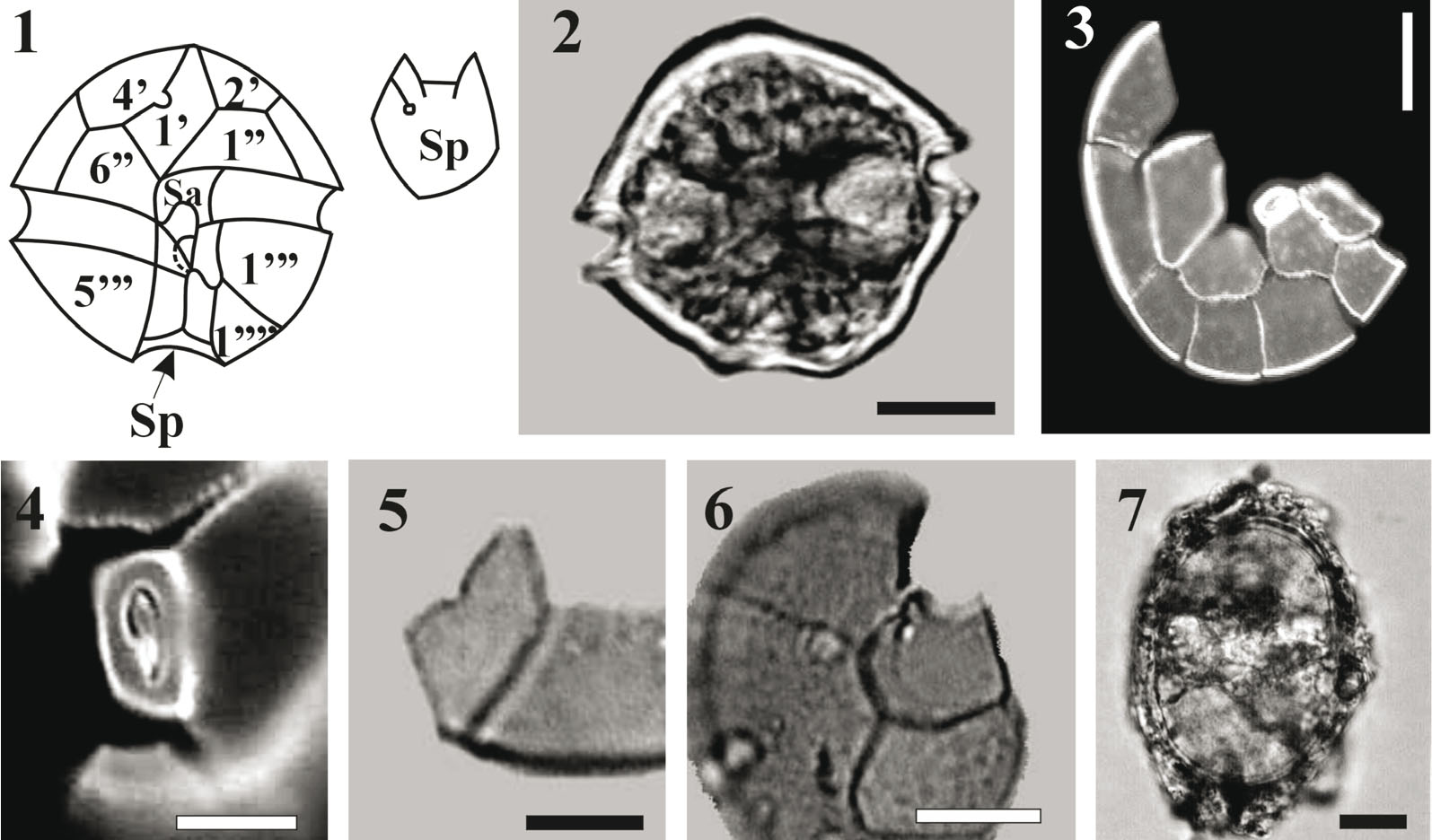
ATRU-16_1–7: 1 – схематичное изображение строения теки и форма задней бороздковой пластинки (Sp); 2 – общий
вид клетки с брюшной стороны; 3 –строение эпитеки разломанной клетки; 4 – поровая пластинка; 5 – первая
апикальная пластинка; 6 – фрагмент гипотеки разломанной клетки; 7 – покоящаяся спора (циста). 2, 5–7 –
световая микроскопия; 3, 4 – люминесцентная световая микроскопия.
Характеристика объекта культивирования
|
Таксон |
Pseudo-nitzschia pungens (Grunow ex P.T. Cleve) Hasle |
|
Шифр клона |
PP-07 |
|
Иллюстрации |
PP-07_1–6 |
|
Класс |
Bacillariophyceae |
|
Порядок |
Bacillariales |
|
Семейство |
Bacillariaceae |
|
Род |
Pseudo-nitzschia |
|
Морфологическое описание |
Клетки соединяются короткими участками в длинные прямые подвижные колонии (PP-07_1). Створки линейно-ланцетовидные, симметричные относительно апикальной оси (PP-07_2). Центральный узелок отсутствует. Два крупных хлоропласта расположены близ центра створки. Концы створок заостренные. Фибулы совпадают с поперечными штрихами, 10–13 в 10 мкм (PP-07_3–6). Структура штриха представлена двумя рядами крупных пороидов, 3-4 в 1 мкм. Иногда отмечается промежуточный третий ряд, состоящий из пороидов меньшего размера (PP-07_5, 6). Первый поясковый ободок (вальвокопула) перфорирован 17-25 штрихами. |
Размеры клетки |
Длина 79.9-109.2 мкм, ширина 2.9-5.0 мкм |
|
Экология и распространение |
По-видимому, имеет космополитическое распространение (Hasle, 2002). В дальневосточных морях России широко распространен в зал. Петра Великого Японского моря и в прибрежных водах о-ва Сахалин (Охотское море). Найден у западного побережья Берингова моря. Вид вызывает «цветения» воды в зал. Петра Великого. Максимальная концентрация (около 1 млн. клеток/л) была зарегистрирована в июне 1993 г. у северо-восточного берега Амурского залива Японского моря в районе г. Владивостока. |
|
Токсичность |
Метод ИФА/ELISA показал, что суммарная концентрация домоевой кислоты в культуре (на стационарной фазе роста) составляла 108.1 пкг/мл. Согласно литературным данным, была установлена токсичность вида в природных условиях и в культурах, изолированных из проб фитопланктона, собранных у западного побережья США и у берегов Новой Зеландии (Rhodes et al., 1996; Trainer et al., 1998). |
|
Изображение |
PP-07_1-6 |
|
Масштабная линейка |
PP-07_1-3 - 10 мкм; PP-07_4-6 - 1 мкм |

PP-07_1-6: 1 – фрагмент колонии; 2 – общий вид створки; 3 – конец створки; 4 – структура лицевой поверхности и
загиба створки; 5 – фрагмент панциря, структура створки; 6 – фрагмент створки с присоединенными к ней двумя
поясковыми ободками. 1, 2 – световая микроскопия, 3–6 –трансмиссионная электронная микроскопия.
Характеристика объекта культивирования
|
Таксон |
Pseudo-nitzschia multiseries (Hasle) Hasle |
|
Шифр клона |
PM-02 |
|
Иллюстрации |
PM-02_1-7 |
|
Класс |
Bacillariophyceae |
|
Порядок |
Bacillariales |
|
Семейство |
Bacillariaceae |
|
Род |
Pseudo-nitzschia |
|
Морфологическое описание |
Клетки соединены короткими участками в длинные прямые подвижные цепочки (PM-02_1). Створки линейно-ланцетные, симметричные, с острыми концами (PM-02_2). Центральный узелок отсутствует. Два крупных хлоропласта расположены близ центра створки. Число фибул примерно совпадает с числом поперечных штрихов, фибул 12-15 в 10 мкм, штрихов 12-17 в 10 мкм (PM-02_3, 4). Структура штриха представлена 3-5 рядами мелких пороидов, 5-7 пороидов в 1 мкм (PM-02_4, 5). Пороиды, расположенные ближе к интерштрихам, немного крупнее остальных пороидов. Первый поясковый ободок (вальвокопула) перфорирован 22-27 штрихами (PM-02_6, 7). |
Размеры клетки |
Длина 36-104 мкм, ширина 3.6-5.0 мкм |
|
Экология и распространение |
Вероятно, имеет космополитическое распространение (Hasle, 2002). В дальневосточных морях России широко распространен в заливе Петра Великого Японского моря и в прибрежных водах о-ва Сахалин (Охотское море), где найден в зал. Анива, у северо-восточного побережья о-ва Сахалин и в Татарском проливе. Вызывает «цветения» воды в зал. Петра Великого Японского моря. Максимальная концентрация (11 млн. клеток/л) зарегистрирована в июне 1992 г. у северо-восточного берега Амурского залива Японского моря в районе г. Владивостока. |
|
Токсичность |
Метод высокоэффективной жидкостной хроматографии (HPLC) показал, что суммарная концентрация домоевой кислоты в культуре P. multiseries (на стационарной фазе роста, через 20–35 сут содержания в культуре) составляла 180–5390 нг/мл. Внутриклеточная концентрация домоевой кислоты составляла 2–21 пкг/кл. Согласно литературным данным, установлена токсичность вида в природных условиях и в культуре для клонов, изолированных из проб фитопланктона, собранных у восточного побережья Канады, у западного побережья США, у берегов Японии (Bates et al., 1989; Villac et al., 1993; Kotaki et al., 1999). |
|
Изображение |
PM-02_1-7 |
|
Масштабная линейка |
PM-02_1-3 - 10 мкм; PM-02_4-7 - 1 мкм |

PM-02_1-7: 1 – колония из двух клеток; 2 - две неразделившиеся клетки; 3 - cтворка; 4 - структура створки; 5 -
фрагмент створки с прикрепленными к ней поясковыми ободками; 6, 7 - структура поясковых ободков. 1, 2 -
световая микроскопия, 3-7 - трансмиссионная электронная микроскопия.
Характеристика объекта культивирования
|
Таксон |
Pseudo-nitzschia сalliantha Lundholm, Moestrup et Hasle |
|
Шифр клона |
PPD-02 |
|
Иллюстрации |
PPD-02_1-7 |
|
Класс |
Bacillariophyceae |
|
Порядок |
Bacillariales |
|
Семейство |
Bacillariaceae |
|
Род |
Pseudo-nitzschia |
|
Морфологическое описание |
Клетки соединены в цепочки (PPD-02_1). Створки линейные, постепенно сужающиеся в направлении коротких заостренных концов (PPD-02_2,3). Имеется центральный узелок (PPD-02_4, 5, стрелки). Число штрихов (35-39 в 10 мкм) превышает число фибул (12-21 в 10 мкм). Структура штриха из одного ряда прямоугольных или округлых пороидов, 4–5 пороидов в 1 мкм (PPD-02_5, 6). Пороиды замкнуты велумом, разделенным на 4–11 секторов (PPD-02_5, 6). Первый поясковый ободок (вальвокопула), а также второй (II) и третий (III) поясковые ободки перфорированы 41–48 штрихами в 10 мкм (PPD-02_7). |
Размеры клетки |
Длина 40-94 мкм, ширина 1.5-1.8 мкм |
|
Экология и распространение |
Вероятно, имеет космополитическое распространение (Hasle, 2002). В дальневосточных морях России широко распространен в зал. Петра Великого Японского моря и в прибрежных водах о-ва Сахалин (Охотское море), где найден в зал. Анива, у северо-восточного побережья о-ва Сахалин, в зал. Академия и в Сахалинском заливе, а также в Амурском лимане и в Татарском проливе. Вызывает «цветения» воды в зал. Петра Великого. Максимальная концентрация (2.6 млн. клеток/л) зарегистрирована в ноябре 1997 г. у северо-восточного берега Амурского залива Японского моря. |
|
Токсичность |
Методом высокоэффективной жидкостной хроматографии (HPLC) домоевая кислота в указанном клоне не обнаружена (Orlova et al., 2008). Согласно литературным данным, установлена токсичность вида в природных условиях в период его «цветения» у берегов Канады (Martin et al., 1990). Показана токсичность клонов, изолированных из проб фитопланктона, собранных у берегов Дании (Lundholm et al., 1997). |
|
Изображение |
PPD-02_1–7 |
|
Масштабная линейка |
PPD-02_1–3 - 10 мкм; PPD-02_4–7 - 1 мкм |
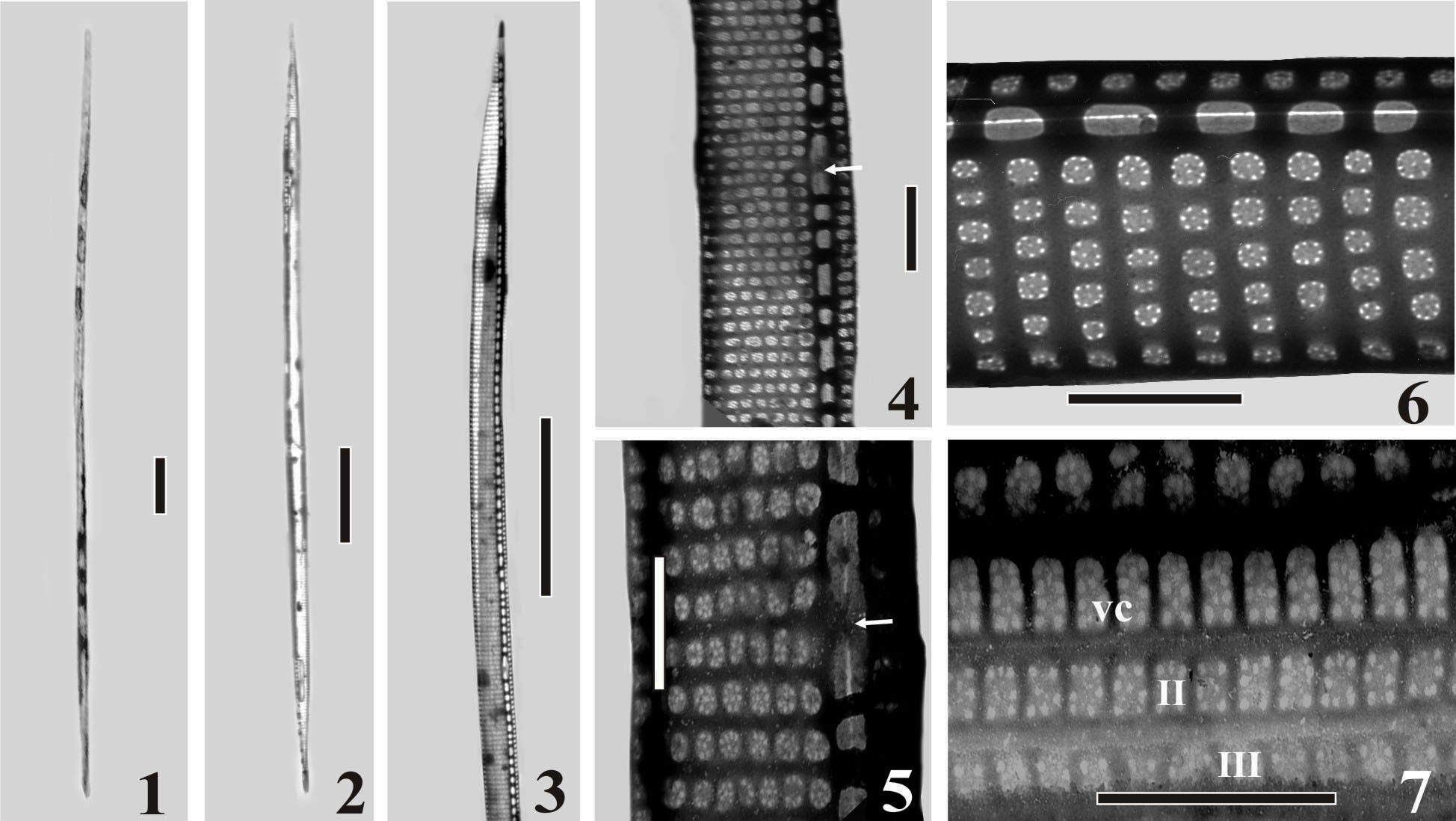
PPD-02_1-7: 1 – колония из двух клеток; 2 – общий вид клетки; 3 – конец створки; 4, 5 – фрагменты двух створок;
6 – структура пороидов; 7 – структура вальвокопулы (vc), второго (II) и третьего (III) поясковых ободков. 1, 2 –
световая микроскопия, 3–7 – трансмиссионная электронная микроскопия.
Характеристика объекта культивирования
|
Таксон |
Pseudo-nitzschia multistriata Takano |
|
Шифр клона |
PMS-04 |
|
Иллюстрации |
PMS-04_1–5 |
|
Класс |
Bacillariophyceae |
|
Порядок |
Bacillariales |
|
Семейство |
Bacillariaceae |
|
Род |
Pseudo-nitzschia |
|
Морфологическое описание |
Клетки соединены в короткие цепочки (PMS-04_1). Клетки сигмовидные со стороны пояска (PMS-04_2). Створки линейные в средней части, сужающиеся в направлении закругленных концов. Центральный узелок отсутствует (PMS-04_3). Число штрихов (35-40 в 10 мкм) превышает число фибул (25-26 в 10 мкм) (PMS-04_3, 4). Структура штрихов из двух (редко трех) рядов пороидов, 9-13 в 1мкм (PMS-04_3, 4). Первый поясковый ободок (вальвокопула) и второй поясковый ободок перфорированы 45-50 штрихами в 10 мкм (PMS-04_5). |
Размеры клетки |
Длина 44-78 мкм, ширина 2.4-3.8 мкм |
|
Экология и распространение |
Сведения о распространении вида немногочисленны. Вид найден у берегов Японии (Takano, 1993), в Южно-Китайском море (Qi et al., 1994), у берегов Южной Кореи (Cho et al., 2002), Новой Зеландии (Rhodes et al., 2000), Бразилии (Villac et al. 2004) и в Неаполитанском заливе (Orsini et al., 2002). В дальневосточных морях России широко распространен в зал. Петра Великого Японского моря и в прибрежных водах о-ва Сахалин (Охотское море), где найден в зал. Анива и в Сахалинском заливе. Вызывает «цветения» воды в зал. Петра Великого. Максимальная концентрация (1.5 млн. клеток/л) зарегистрирована в октябре 2005 г. в Амурском заливе Японского моря. |
|
Токсичность |
Методом высокоэффективной жидкостной хроматографии (HPLC) домоевая кислота в указанном клоне не обнаружена (Orlova et al., 2008). Согласно литературным данным, установлена токсичность клонов, изолированных из прибрежных вод Италии (Sarno, Dahlmann, 2000). |
|
Изображение |
PMS-04_1-5 |
|
Масштабная линейка |
PMS-04_1-2 - 10 мкм; PMS-04_3-5 - 1 мкм |

PMS-04_1-5: 1 – колония из двух клеток; 2 – общий вид клетки; 3, 4 – части двух створок, структура пороидов; 5 –
структура штрихов вальвокопулы (vc) и второго пояскового ободка (II). 1 – световая микроскопия, 2–5 –
трансмиссионная электронная микроскопия.
Паспорт на культуру одноклеточных водорослей
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Alexandrium tamarense |
|
Шифр клона |
ATRU-16 |
|
Cборщик |
Орлова Т.Ю. |
|
Место сбора |
Амурский залив Японского моря (43°15' c.ш., 131°50' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
16.08.2000 |
|
Выделен в культуру |
Орлова Т.Ю. |
|
Дата выделения |
03.03.2001 |
|
Вид определен |
Орлова Т.Ю., Селина М.С. |
|
Тип культуры |
Клоновая |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f/2 |
|
Температура культивирования |
15ºC |
|
Плотность культуры, клетки/мл |
1×104–2×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
23–43 |
|
Ширина клетки, мкм |
22.5–45 |
|
Токсичность |
По данным метода высокоэффективной жидкостной хроматографии (HPLC), клон токсичен, содержит сакситоксин и его производные, характеризуется высоким содержанием токсинов С1, С2, неосакситоксина и гонитоксина 5 (Orlova et al., 2007) |
|
Флюоресценция |
Нет данных |
|
Примечание |
Генетический анализ крупных субъединиц рибосомной РНК показал, что клон принадлежит к популяции JAT (японский умеренно азиатский риботип) (Orlova et al., 2007) |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Alexandrium tamarense |
|
Шифр клона |
ATRU-22 |
|
Cборщик |
Морозова Т.В. |
|
Место сбора |
Авачинская губа, п-ов Камчатка (53°02' c.ш., 158°35' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
07.09.2001 |
|
Выделен в культуру |
Орлова Т.Ю. |
|
Дата выделения |
03.03.2002 |
|
Вид определен |
Орлова Т.Ю., Селина М.С. |
|
Тип культуры |
Клоновая |
|
Место хранения |
Коллекция культур микроводорослей Института биологии моря им. А.В. Жирмунского ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f/2 |
|
Температура культивирования |
15ºC |
|
Плотность культуры, клетки/мл |
1×104–2×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
42–45 |
|
Ширина клетки, мкм |
39–43 |
|
Токсичность |
По данным метода высокоэффективной жидкостной хроматографии (HPLC), клон токсичен, содержит сакситоксин и его производные, характеризуется высоким содержанием токсинов GTX 2,3 (35%) низким уровнем GTX 1,4 и GTX 5 (6 и 11% соответственно). Содержание неосакситоксина и сакситоксина составляет 1 и 0.3 соответственно (Orlova et al., 2007) |
|
Флюоресценция |
Нет данных |
|
Примечание |
Генетический анализ крупных субъединиц рибосомной РНК показал, что клон принадлежит к популяции WNA (западный североамериканский риботип) (Orlova et al., 2007) |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Alexandrium tamarense |
|
Шифр клона |
ATRU-2/1 |
|
Cборщик |
Федотов П.А. |
|
Место сбора |
Берингово море (60°21' c.ш., 170°37' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
21.07.2002 |
|
Выделен в культуру |
Орлова Т.Ю. |
|
Дата выделения |
03.03.2003 |
|
Вид определен |
Орлова Т.Ю., Селина М.С. |
|
Тип культуры |
Клоновая |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f/2 |
|
Температура культивирования |
15ºC |
|
Плотность культуры, клетки/мл |
1×104–2×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
35–39 |
|
Ширина клетки, мкм |
34.5–39 |
|
Токсичность |
По данным метода высокоэффективной жидкостной хроматографии (HPLC), клон токсичен, содержит сакситоксин и его производные, характеризуется высоким содержанием токсинов GTX 5 (51%), deSTX (9%) и STX (28%) (Orlova et al., 2007) |
|
Флюоресценция |
Нет данных |
|
Примечание |
Генетический анализ крупных субъединиц рибосомной РНК показал, что клон принадлежит к популяции ENA (восточный североамериканский риботип) (Orlova et al., 2007) |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Alexandrium tamarense |
|
Шифр клона |
ATA-10 |
|
Cборщик |
Масленников С.И. |
|
Место сбора |
Зал. Анива (60°21' c.ш., 170°37' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
21.07.2009 |
|
Выделен в культуру |
Литвинова Н.Г. |
|
Дата выделения |
03.03.2010 |
|
Вид определен |
Орлова Т.Ю., Селина М.С. |
|
Тип культуры |
Клоновая |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f/2 |
|
Температура культивирования |
15ºC |
|
Плотность культуры, клетки/мл |
1×104–2×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
35–39 |
|
Ширина клетки, мкм |
34.5–39 |
|
Токсичность |
Нет данных |
|
Флюоресценция |
Нет данных |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Amphidinium carterae |
|
Шифр клона |
AC10/1 |
|
Cборщик |
Селина М.С. |
|
Место сбора |
Б. Соболь Уссурийского залива |
|
Океан |
Тихий океан |
|
Дата сбора |
07.10.09 |
|
Выделен в культуру |
Селина М.С. |
|
Дата выделения |
19.03.2010 |
|
Вид определен |
Селина М.С. |
|
Тип культуры |
Клоновая |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f/2 |
|
Температура культивирования |
15ºC |
|
Плотность культуры, клетки/мл |
|
|
Длина клетки, мкм |
23–43 |
|
Ширина клетки, мкм |
22.5–45 |
|
Токсичность |
Нет данных |
|
Флюоресценция |
Нет данных |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Amphidinium carterae |
|
Шифр клона |
AC-Москва |
|
Cборщик |
Неизвестен |
|
Место сбора |
Неизвестно |
|
Океан |
|
|
Дата сбора |
Неизвестна |
|
Выделен в культуру |
Неизвестно |
|
Дата выделения |
Неизвестна |
|
Вид определен |
Селина М.С. |
|
Тип культуры |
Клоновая |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f/2 |
|
Температура культивирования |
15ºC |
|
Плотность культуры, клетки/мл |
|
|
Длина клетки, мкм |
|
|
Ширина клетки, мкм |
|
|
Токсичность |
Нет данных |
|
Флюоресценция |
Нет данных |
|
Примечание |
Культура передана из МГУ (Москва), пересажена в пластиковые флаконы 30.03.2010 |
№ _____ПАСПОРТ на культуру (штамм) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia multiseries |
|
Шифр клона |
PM-02 |
|
Cборщик |
Айздайчер Н.А. |
|
Место сбора |
Амурский залив Японского моря (43°11' c.ш., 131°54' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
29.10.2002 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
01.11.2002 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
Неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
20-22ºC |
|
Плотность культуры, клетки/мл |
2×104–4×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
36–104 |
|
Ширина клетки, мкм |
3.6–5.0 |
|
Токсичность |
Суммарная концентрация домоевой кислоты составляла 180-5390 нг/мл (через 20–35 сут содержания в культуре); внутриклеточная концентрация домоевой кислоты составляла 2-21 пкг/клетку (метод высокоэффективной жидкостной хроматографии (HPLC)) |
|
Флюоресценция |
Полоса излучения хлорофилла в области 665-715 нм (метод измерения флюоресценции – лазерная конфокальная микроскопия LEICA TCS SPE) |
|
Примечание |
При скрещивании с клонами CLN-46, CLN-48 и CLN-50, изолированными из восточных прибрежных вод Канады, отмечено образование гамет, которое не приводило к образованию зигот, ауксоспор и инициальных клеток |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia сalliantha |
|
Шифр клона |
PPD-02 |
|
Cборщик |
Попов Ю.П. |
|
Место сбора |
Уссурийский залив Японского моря (43°45' c.ш., 132°16' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
21.11.2002 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
24.11.2002 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
20-22ºC |
|
Плотность культуры, клетки/мл |
2×104–3×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
40–87 |
|
Ширина клетки, мкм |
1.5–1.8 |
|
Токсичность |
Методом высокоэффективной жидкостной хроматографии (HPLC) домоевая кислота не обнаружена в данном клоне (Orlova et al., 2008) |
|
Флюоресценция |
Нет данных |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia multistriata |
|
Шифр клона |
PMS-04 |
|
Cборщик |
Попов Ю.П. |
|
Место сбора |
Амурский залив Японского моря (43°09' c.ш., 131°54' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
19.11.2004 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
21.11.2004 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
Неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
20–22ºC |
|
Плотность культуры, клетки/мл |
2×104–3×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
44–58 |
|
Ширина клетки, мкм |
2.4–3.4 |
|
Токсичность |
Методом высокоэффективной жидкостной хроматографии (HPLC) домоевая кислота не обнаружена в данном клоне (Orlova et al., 2008) |
|
Флюоресценция |
Нет данных |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia pungens |
|
Шифр клона |
PP-07 |
|
Cборщик |
Попов Ю.П. |
|
Место сбора |
Зал. Восток Японского моря (42°53' c.ш., 132°44' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
10.12.2007 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
14.12.2007 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
Неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
16–17ºC |
|
Плотность культуры, клетки/мл |
3×104–5×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
79.9–109.2 |
|
Ширина клетки, мкм |
2.9–5.0 |
|
Токсичность |
Метод иммуноферментного анализа с использованием тест-системы «ASP direct ELISA» (ИФА/ELISA) показал, что суммарная концентрация домоевой кислоты в культуре (на стационарной фазе роста) составляла 108.1 пкг/мл |
|
Флюоресценция |
Полоса излучения хлорофилла в области 670–685 нм (Метод измерения флюоресценции – лазерная конфокальная микроскопия LEICA TCS SPE) |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia pungens |
|
Шифр клона |
PP-08 |
|
Cборщик |
Попов Ю.П. |
|
Место сбора |
Зал. Восток Японского моря (42°53' c.ш., 132°44' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
21.09.2008 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
24.09.2008 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
Неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
18–20ºC |
|
Плотность культуры, клетки/мл |
2×104–4×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
85–112 |
|
Ширина клетки, мкм |
2.5–5.0 |
|
Токсичность |
Суммарная концентрация домоевой кислоты составляла 115.4 пкг/мл (через 30 сут содержания в культуре) (метод ИФА/ELISA) |
|
Флюоресценция |
Нет данных |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia pungens (Grunow ex P.T. Cleve) Hasle |
|
Шифр клона |
PP-081 |
|
Cборщик |
Стоник И.В. |
|
Место сбора |
Б. Золотой Рог Японского моря (43°10' c.ш., 131°88' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
12.07.2008 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
14.07.2008 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
Неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
15–18ºC |
|
Плотность культуры, клетки/мл |
2×104–3×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
74–120 |
|
Ширина клетки, мкм |
2.8–5.0 |
|
Токсичность |
Суммарная концентрация домоевой кислоты составляла 52.3 пкг/мл через 30 сут содержания в культуре (метод ИФА/ELISA) |
|
Флюоресценция |
Нет данных |
|
Примечание |
№ _____ПАСПОРТ на культуру (клон) одноклеточных водорослей
|
Таксон |
Pseudo-nitzschia pungens (Grunow ex P.T. Cleve) Hasle |
|
Шифр клона |
PP-10 |
|
Cборщик |
Стоник И.В. |
|
Место сбора |
Б. Золотой Рог Японского моря (43°10' c.ш., 131°88' в.д.) |
|
Океан |
Тихий океан |
|
Дата сбора |
3.08.2010 |
|
Выделен в культуру |
Айздайчер Н.А. |
|
Дата выделения |
5.08.2010 |
|
Вид определен |
Стоник И.В. |
|
Тип культуры |
Неаксеничная (альгологически чистая) |
|
Место хранения |
Коллекция культур микроводорослей ИБМ ДВО РАН (690041, г. Владивосток, ул. Пальчевского, 17) |
|
Среда для культивирования |
f |
|
Температура культивирования |
18–20ºC |
|
Плотность культуры, клетки/мл |
2×104–4×104 (на стадии экспоненциального роста) |
|
Длина клетки, мкм |
82–115 |
|
Ширина клетки, мкм |
2.6–5.0 |
|
Токсичность |
Нет данных |
|
Флюоресценция |
Нет данных |
|
Примечание |
Протокол анализа №____
|
1 |
Дата анализа |
27 августа 2008 г. |
|
2 |
Место отбора (наименование точки отбора), координаты |
о-в Рикорда, Амурский залив, Японское море (42°53' с.ш., 131°40' в.д.) |
|
3 |
Дата отбора |
20 апреля 2008 г. |
|
4 |
Вид пробы |
Разовая |
|
5 |
Используемый пробоотборник |
Зачерпывание ведром с поверхности |
|
6 |
Номер на емкости |
1–20/20_04_2008 |
|
7 |
Материал, вместимость |
Бутылки пластиковые, из полиэтилентерефталата, 18900 мл |
|
8 |
Анализируемый параметр |
Концентрация O2 (мл/л) и биогенных элементов (мкг/л), величина БПК5 (мл/л) |
|
8.1 |
O2 |
4.71 |
|
8.2 |
БПК5 |
0.1 |
|
8.3 |
N-NO2 |
0 |
|
8.4 |
N-NO3 |
0.39 |
|
8.5 |
N-NO4 |
0 |
|
8.6 |
P-PO4 |
0.28 |
|
8.7 |
Si-SiO3 |
1.75 |
|
Примечание |
Анализируемая вода находится в состоянии постоянного устойчивого равновесия и не будет претерпевать изменений в солевом составе при дальнейшем хранении. |
|
|
9 |
Анализ выполнен |
Пропп Л.Н. |
Протокол отбора проб №____
|
1 |
Цель пробоотбора |
Выделение в монокультуру Alexandrium tamarense |
|
2 |
Дата и время отбора |
16.08.2000, 11ч |
|
3 |
Место отбора (наименование точки отбора), координаты |
Амурский залив, Японское море, 43°15′ с.ш., 131°50′ в.д. |
|
4 |
Объект отбираемой пробы |
Виды рода Alexandrium |
|
5 |
Вид пробы |
Разовая |
|
6 |
Используемый пробоотборник |
Дночерпатель van Veen (площадь захвата 0.2 м2) |
|
7 |
Глубина |
16 м |
|
8 |
Тип грунта |
Ил |
|
9 |
Условия отбора |
S=32.1‰, t=21°C |
|
10 |
Отбор выполнен |
Орлова Т.Ю. |
|
Примечание |
Протокол отбора проб №____
|
1 |
Цель пробоотбора |
Выделение в монокультуру Pseudo--nitzschia multiseries |
|
2 |
Дата и время отбора |
1.11.02 11ч |
|
3 |
Место отбора (наименование точки отбора), координаты |
Амурский залив, Японское море, 43°11′ с.ш., 131°54′ в.д. |
|
4 |
Объект отбираемой пробы |
Виды рода Pseudo-nitzschia |
|
5 |
Вид пробы |
Разовая |
|
6 |
Используемый пробоотборник |
Батометр системы Молчанова |
|
7 |
Номер на емкости |
|
|
8 |
Материал емкости |
|
|
9 |
Условия отбора |
S=32.1‰ t=8°C pH=8.1 O2 =6-8 мг/л |
|
10 |
Отбор выполнен |
Попов Ю.П. |
|
Примечание |
Мы используем средства измерений, реактивы и материалы, приведенные в списке ниже. Допускается использование средств измерений, вспомогательных устройств и материалов другого типа, имеющих аналогичные метрологические характеристики.
Средства измерений
- Весы лабораторные общего назначения 2 класса точности с наибольшим пределом взвешивания 200 г (ГОСТ 24104).
- Весы лабораторные общего назначения 4 класса точности с наибольшим пределом взвешивания 1000 г.
- Меры массы Г-211.10 (ГОСТ 732882).
- Термометр лабораторный шкальный с диапазоном измерения от 0 до 100оС, с ценой деления шкалы 0.1оС (ГОСТ 29224-91).
- Термометр гидрологический (–3 – +6оС), цена деления шкалы 0.5оС, (тип ТМ-14, ГОСТ 112-78).
- Электросолемер ГМ-65М Л82 840 004ПС.
- Одноканальные автоматические пипетки постоянного объема (50 мкл).
- Одноканальные автоматические пипетки переменного объема (100–1000 мкл).
- Колбы мерные объемом 50 и 250 мл (ГОСТ 1770).
- Пипетки градуированные объемом 0.1; 1; 2.5; 5 и 10 мл, класс точности 2 (ГОСТ 29227).
- Цилиндры мерные объемом 25, 50, 100 и 1000 мл, класс точности 2 (ГОСТ1770-74).
- Часы сигнальные ТУ 25-07-57.
Реактивы
- Ацетон чда (ГОСТ 2603-79).
- Калий азотнокислый (KNO3) чда (ГОСТ 4217-77).
- Кислота соляная хч (ГОСТ 3118-74).
- Натрий фосфорнокислый двузамещенный безводный (NaHPO4) ч.
- Натрий фосфорнокислый однозамещенный безводный (Na2HPO4) ч.
- Железо хлористое водное (FeCl3×6H2O) ч (ГОСТ 4147-74).
- Марганец хлористый водный (MnCl2×4H2O) ч (ГОСТ 612-75).
- Кобальт хлористый водный (CoCl2×6H2O) чда (ГОСТ 4525-68).
- Натрий азотнокислый (NaNO3) чда ГОСТ 4197-66.
- Натрий фосфорнокислый однозамещенный водный (NaH2PO4×H2O).
- Натрий кремнекислый водный (Na2SiO3×9H2O).
- Медь сернокислая водная (CuSO4×5H2O) (ГОСТ 4165-78).
- Цинк сернокислый водный (ZnSO4×7H2O) (ГОСТ 4174-77).
- Натрий молибденовокислый водный (Na2MoO3×2H2O) чда (ГОСТ 10981-74).
- Трилон хч (ГОСТ 10652-73).
- Вода бидистиллированная (ГОСТ 6709-72).
- Витамин В1.
- Витамин В7.
- Витамин В12.
- Спирт этиловый (ГОСТ 18300-87).
Вспомогательные устройства и материалы
- Дистилляторы GFL-2004 (Германия, ГОСТ 6709-72) и ASTM D 1193-99.
- Бокс для культивирования водорослей - климатостат (термолюминостат) КС200, СПУ (Россия) или эквивалентное приспособление, позволяющее поддерживать освещение лампами дневного света 3500 лк и температуру воздуха 15–20оС.
- Бокс с ламинарным вертикальным притоком воздуха ВЛ-12-1300, ТУ-9451-001-33172756-94 (ГОСТ Р 50444-92).
- Магнитная мешалка с подогревом MSH-300, (ООО BioSan, Латвия), ТУ 25-11-834-73.
- Микроскоп стереоскопический биологический, универсальный проходящего света Leica EZ4D (Carl Zeiss, Германия), ТУ 3-3-1210-75.
- Микроскоп инвертированный Axiovert 40СFL (Carl Zeiss, Германия).
- Батометр системы «Молчанова» объемом 4 л ГР-18 (Россия).
- Фильтры лавсановые ядерные «Дубна» с диаметром пор 0.2 мкм.
- Ультразвуковая установка Branson Sonifer 450 (Branson Ultrasonics Corp., США).
- Счетные камеры «Седвик-Рафтер» (Sedgewick Rafter Counting Сells) объемом 1 мл.
- Сушильный электрический шкаф общелабораторного назначения BINDER (BINDER GmbH, Германия), ТУ 34-021-223117779-98.
- Термостат водяной TW-2.02, ТУ 64-1-2850-76.
- Микроволновая печь инверторная (Panasonic, Shanghai, КНР).
- Тефлоновые мешалки.
- Магнитная удочка.
- Бутылки пластиковые из окрашенного полиэтилентерефталата, пищевые (Республика Корея), объемом 18900 мл (ГОСТ Р 51760-2001).
- Бутылки пластиковые NALGENE объемом 18900 мл.
- Воронка стеклянная лабораторная (ГОСТ 25336-82Е).
- Банки стеклянные с винтовым горлом, с прокладкой и крышкой или с притертой пробкой объемом до 1000 мл, ТУ 6-19-45-74.
- Груши резиновые разные (пипеточные луковицы), ТУ 38-106003.
- Стаканы стеклянные лабораторные объемом 50, 150, 250 и 1000 мл (ГОСТ 25336-82Е).
- Спиртовка лабораторная стеклянная (ГОСТ 25336-82Е).
- pH-метр-милливольтметр pH-410 4215-008-18294344 РЭ (ГОСТ 29270-95).
- Планшеты пластиковые для культивирования, 96 лунок.
- Пипетки пастеровские.
- Пробирки центрифужные объемом 10 мл (ГОСТ 25336).
- Наконечники для автоматических пипеток.
- Шпатели металлические (ГОСТ 19126-79).
- Чашки Петри одноразового применения диаметром 55–90 мм (ГОСТ 25336-82).
- Колбы стеклянные лабораторные Эрленмейера объемом 250 мл (ГОСТ 25336-82Е).
- Стекла покровные для микропрепаратов (ГОСТ 6672-75).
- Стекла предметные для микропрепаратов (ГОСТ 9284-59).
- Пробирки стеклянные объемом 10–50 мл (ГОСТ 25336-82).
- Пробирки пластиковые конические с крышкой объемом 15–50 мл.
- Штативы для пробирок.
- Бутылки из тефлона объемом 1 л (NALGENE).
- Капроновые фильтры «Nitex» с диаметром пор 20 и 80 мкм.
- Листовая фильтровальная бумага.
- Разовые латексные или виниловые перчатки.
- Тара для лабораторных отходов.











